
微信扫一扫立即咨询



细胞培养上清
①将细胞培养上清液吸入离心管中,在2-8℃下以1000×g离心20分钟,除去细胞碎片和杂质,收集上清液备用,
②样本保存在-20℃或-80℃,避免反复冻融。
01 uniprot
Q:那什么情况下需要测细胞裂解液,什么情况下是检测细胞培养液上清呢?
A:首先从细胞培养的形态(贴壁细胞、悬浮细胞)所检测蛋白分泌表达位置:
在uniprot蛋白数据库中Subcellular Location 栏目可查到该蛋白的分泌表达部位
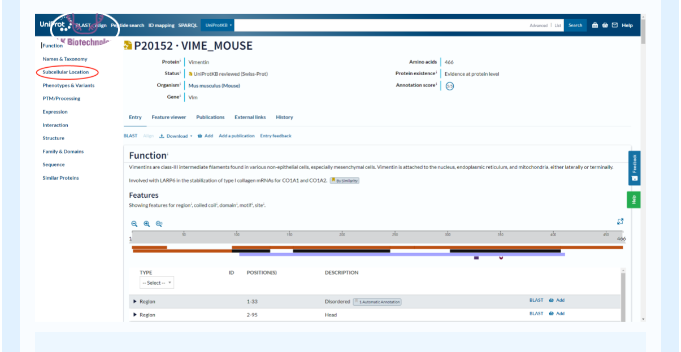
例1:mouse 白介素6的分泌表达位置,细胞质,质膜,胞外表达。
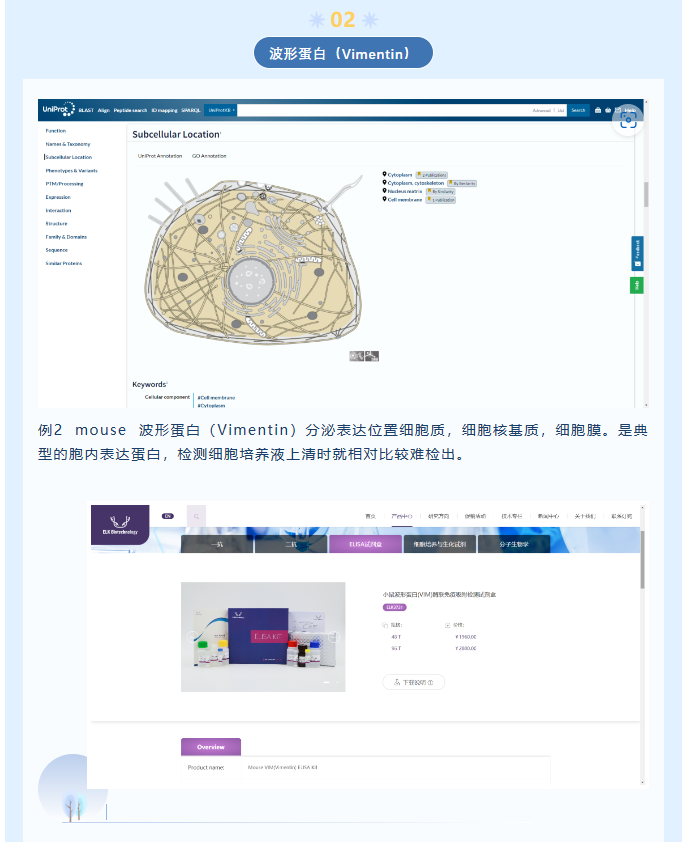
一般采用0.05mol/LTris-HCl,pH7.4磷酸盐缓冲液(PBS),客户可根据样本及测定指标的情况自行设定浓度,目的是保持样本的等渗环境。
1、细胞沉淀的收集:
①悬浮细胞:对于悬浮培养的细胞,直接通过离心收集细胞沉淀,将培养液在室温条件下1000转/分,离心10分钟,弃上清留细胞沉淀。
②贴壁细胞:对于贴壁培养的细胞,用胰酶将细胞消化下来,或用细胞刮将细胞刮下来,将培养液在室温条件下1000转/分,离心10分钟,弃上清留细胞沉淀。
我们一般建议客户,细胞密度不要小于106个/ml。
2、细胞沉淀的洗涤:
在细胞沉淀中加入0.5-1ml的PBS(等渗),轻轻颠倒混匀,将培养液在室温条件下1000转/分,离心10分钟,弃上清留细胞沉淀。重复上述操作反复洗涤1~2次。
手工匀浆,超声破碎,裂解液裂解,反复冻融。
①手工匀浆:在细胞沉淀中加入一定量的PBS(PBS的加入量根据所测指标的不同而有所改变,一般加入0.5ml,细胞密度不小于一百万个/ml),混匀,将细胞悬浮于PBS中,用移液器将细胞悬浮液移至玻璃匀浆管中(2ml玻璃匀浆管),将玻璃匀浆管置于冰水混合物中,手动匀浆3分钟,然后取破碎好的细胞悬浮液进行测定。
②超声破碎:
在细胞沉淀中加入一定量的PBS(PBS的加入量根据所测指标的不同而有所改变,一般加入0.5ml,细胞密度不小于一百万个/ml),混匀,将细胞悬浮于PBS中,在冰水浴条件下进行如下操作:
a、用超声粉碎机进行粉碎,可用Soniprep150型超声波发生器以振幅14微米超声处理30秒使细胞破碎,也可用国产超声波发生仪,用400安培,5秒/次,间隙10秒反复3~5次。
b、用超声细胞破碎仪,300W功率,每次超声3~5秒,间隔30秒,重复4~5次。
③裂解液裂解
常用裂解液有SDS、NP-40、TritonX-100,这三种去垢剂的作用是不同的,或者说作用力量强弱不同。
1、SDS属于离子型去垢剂,效果最强,基本可以把细胞核膜破坏掉,DNA会释放出来,裂解液变得很粘稠。
2、NP-40是很温和的去垢剂,1%浓度的基本可以破坏掉胞膜,而对核膜破坏的作用弱,结合特定的buffer可以获得胞浆蛋白。
3、TritonX-100的能力介于NP40和SDS之间,偏向于NP40,也是常用的细胞裂解液成分之一,在保护蛋白活性方面有一定作用(SDS基本会使蛋白变性失活)。
去垢剂属性只是一方面,buffer、配比、浓度、提取方法和材料处理也都是关键因素
由于很多裂解液都是蛋白变性剂,对酶活力的测定有一定的影响,一般不推荐用裂解液进行裂解。
④反复冻融:
在细胞沉淀中加入一定量的PBS(PBS的加入量根据所测指标的不同而有所改变,一般加入0.5ml,细胞密度不小于一百万个/ml),混匀,将细胞悬浮于PBS中,放低温冰箱中结冰,溶解,再结冰,再溶解,反复3次左右)。由于反复冻融对酶活力影响较大,一般使用生化法测酶活时不能使用。

关注微信公众号

微信扫一扫立即咨询

微信扫一扫立即咨询