
微信扫一扫立即咨询


常见小鼠采血方法
小鼠是科研实验中常用的实验动物,但由于其体积小,血管细,采血难度大,进而影响采血的质量。
ELK简要总结了常见的小鼠采血方法,仅供参考:
一只成年小鼠的循环血量大约是1.5~2.5ml,大约体重的 6~8%。在对营养状况良好的小鼠进行采血时,单次采血量最多可以到达循环血量的10%,(例:若20克小鼠,它的总血量约占1.2-1.4毫升,即每次取120ul-140ul血液不会对小鼠有太大的影响)。采血之后应该给予温热的等渗溶液补充,可以在2~3个星期内恢复原有的水平。两周采血量小于血液循环的10%,单周小于7.5%,小鼠血液循环72ml/kg
实验室常用抗凝剂:乙二胺四乙酸(EDTA)盐、枸橼酸盐、草酸盐、肝素
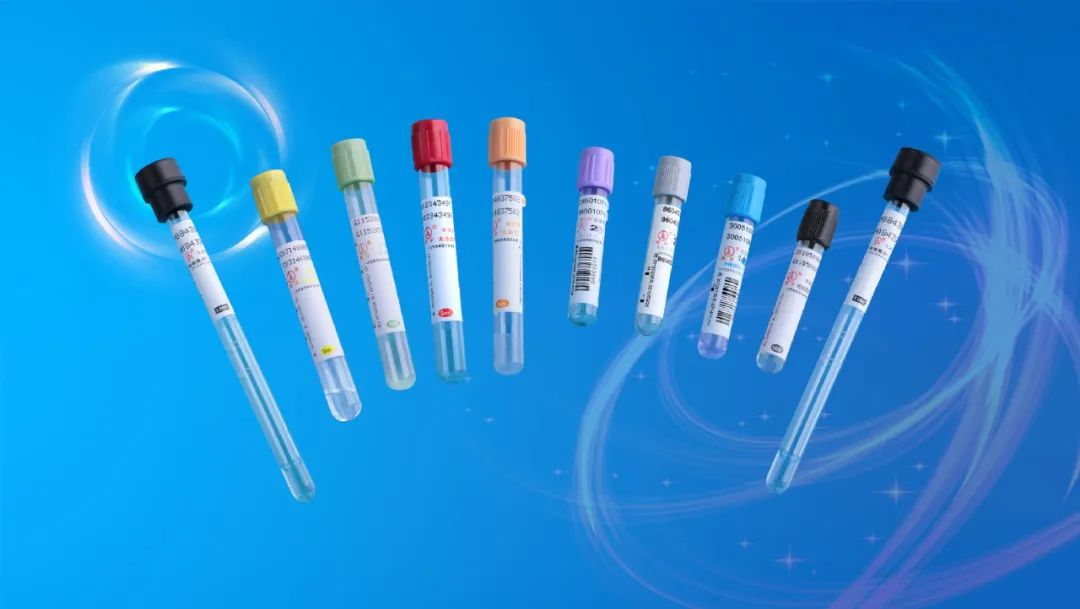
实验室常用采血管:(采血后立即颠倒混匀8次)
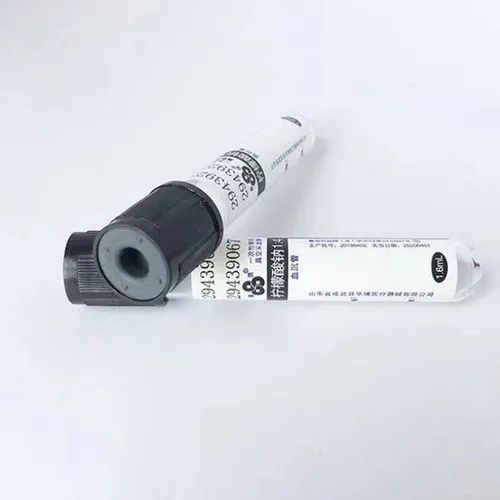
1.黑色:枸橼酸钠;血沉
2.浅蓝色:枸橼酸钠;血凝试验(如PT、APTT)
3.深蓝色:肝素钠或EDTA-Na2;血液微量元素
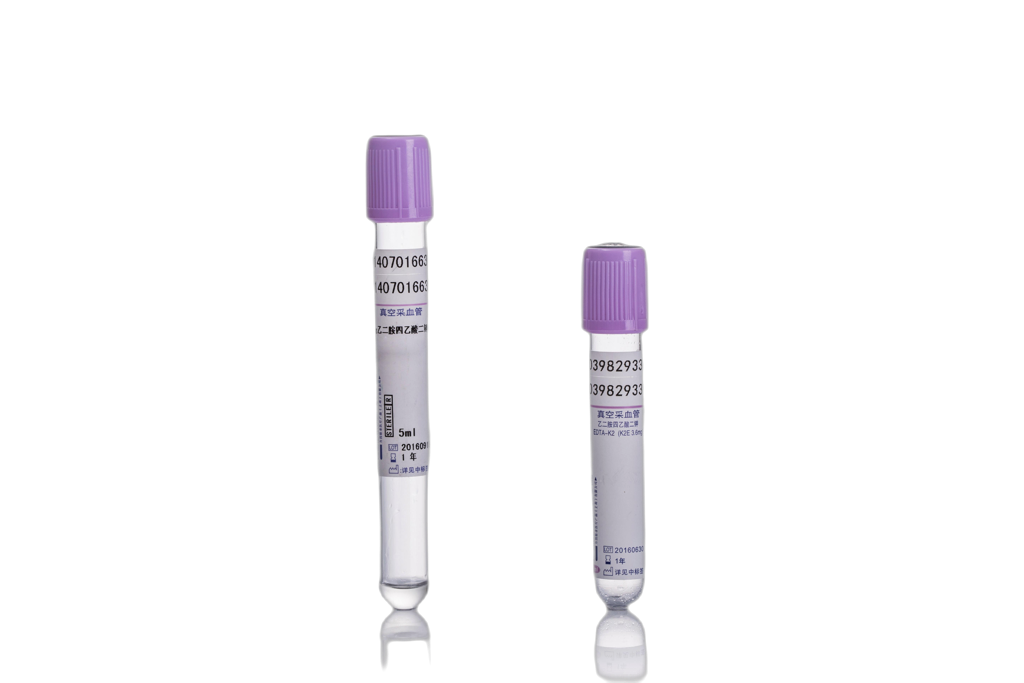
4.紫色:EDTA-K2;血常规(血液细胞分析)
5.绿色:肝素锂;大部分生化、血氨
6.灰色:血糖降解抑制剂和EDTA-Na2;血糖
7.棕色:肝素钠或EDTA-K2;血铅
8.浅黄色ACD管:葡萄糖、抗凝剂;血库试验
9.浅黄色SPS管:SPS液、氯化钠溶液;血液培养、微生物培养

尾尖采血
麻醉小鼠后,用温水(但水温不要过高)擦拭尾巴,引起轻微的血管扩张。
用无菌手术刀、刀片或锋利的剪刀,快速截断小鼠尾尖0.5-1cm。如果需要多次采血,之后每次仅需截除2-3mm。
可以从尾部向尾尖方向按摩,以增加血流(但是,这会降低血样的质量,增加溶血的风险)。也可以用毛细采血管收集血液,或直接滴入收集管中。采血结束后,按压伤口或使用止血剂(如硝酸银,6%液体火棉胶)来止血。每次采血量大约可达0.1ml。
眼眶静脉丛采血
优点:眼眶后静脉丛采血法方法简单,便于掌握。血流较快,采血量多,能在较短时间内采约0.5mL血。伤口较小,愈合较快。成功率高,死亡率低。
缺点:不能避免组织液的混入,对于血样要求较高的研究应谨慎使用。
小鼠经气体麻醉后,左手拇指及食指压迫小鼠的颈部两侧,阻碍静脉回流,使眼球充分外突,提示眼眶后静脉丛充血。也可以将小鼠放置在侧卧位,拇指与食指分别置于小鼠头顶和下颌,将皮肤向后及向下拉。抓握时要避免对气管施压,否则可能会影响小鼠呼吸。
将毛细采血管(建议采用0.5*100mm规格的毛细管,在使用前折成小段,每段大约3-4cm)置于内侧眼角处,并且以与鼻翼平面成30-45度沿内眦插入内眼角,滑入眼球后方,轻轻向眼底方向刺入。
当感到有阻力时即轻轻旋转采血管的同时施加压力以切开静脉丛,血液将通过毛细作用流入采血管。不能刺地过深,一般2-3mm即可。
采血结束后,立即松开手指对小鼠的压迫,使眼球复位,同时将采血器拔出。可用干棉球压住眼眶,确保止血。一般眼眶静脉丛采血量可以达到0.2-0.3ml。
颌下静脉采血
绑定小鼠,可将小鼠侧卧,使小鼠头部尽量固定。在小鼠嘴角沿线与外眼角线橡胶处找到颌下静脉的大致位置,会发现一个无毛的小点,有点像酒窝,基本位于嘴角远端稍低于下巴线。
针保持垂直于皮肤表面,刺入皮肤。深度不超过针头的斜面(约3mm)。拔出针头后,血液就会流出。为方便采血,可使小鼠头部低于心脏高度。采血结束后,按压以止血。一般采血量为0.2-0.5ml。
隐静脉采血(总量5%)
将小鼠置于固定管或架中,但保持后腿可自由活动,剃除跗部的毛。为使膝盖与踝关节之间的隐静脉更加明显,可以在后腿膝盖以上使用止血带。在近尾侧的皮肤表面可以找到隐静脉。
针垂直于皮肤表面扎破血管。不要进针过深,以免刺穿肌肉或碰到骨头。血液会从入针处慢慢流出,用毛细采血管收集,并松开止血带。采血结束后,按压伤口或使用止血剂(如硝酸银)以止血,并将小鼠放回笼内。
舌下静脉采血
将小鼠麻醉后仰卧于实验台面上并固定。用眼科弯镊将小鼠舌头拉出,可明显看到小鼠舌下静脉。
持采血针与舌面呈10°夹角插入舌下静脉,见有回血缓慢抽取,直至采到所需血量。
颈静脉采血
该方法采血量( 0.2 ml至近全血量) 及采血次数( 1~8次/d) 可随分析目的而变动,适用于人手少、动物数量多、实验时间紧以及药代动力学等需连续少量取血的研究中。但要求技术熟练, 方能得心应手。在一定时间内, 如果采血量和采血次数增加, 会使动物引起一定的应激性反应或采血部位的伤害。
将动物胸前区采血部位皮肤消毒, 于胸前正中线约第四肋骨水平先用注射器针头沿水平方向刺入皮肤。
再向颈静脉所在位置沿皮下进针, 针头到达颈静脉所在位置时, 轻引注射器内筒使之呈负压, 再使注射器与胸部表面成30°~ 40°角向颈静脉刺入, 此时注射器应与颈静脉走行方向相一致。
在刺入过程中, 速度要缓慢, 刺入的深度约5 mm, 在试探性缓慢刺入或拔出时, 如有血液自动流入注射器内筒, 说明针尖已在颈静脉内, 此时固定好动物, 勿使注射器针头移动。
也可将采血针抵在动物胸骨上以便于操作, 小心抽引注射器内筒, 待血液足够时, 拔出采血针, 用干棉球按压止血。
尾静脉采血
一个人可以用微型手电筒或LED小夜灯等紧贴尾静脉,在灯光的照射下,尾静脉会被很清晰的显示,提高成功率。
固定器(自行设计)小鼠,将尾巴拉直,用酒精棉球擦拭尾巴或者用热水或者热毛巾焐热尾巴(热水浸泡鼠尾), 使尾部静脉扩张。
用左边手的食指,中指,无名指及大拇指将小鼠尾巴固定。
握住1ml 注射器(选用29G的针头为宜)前面0.1ml处,右手小指搭在拽着鼠尾的左手拇指处斜15°角缓慢进针(鼠尾远端约1/3的位置)。适当增加内压看有无回血,若有回血则缓慢抽取所需血量,棉签按压止血。
颌下静脉采血
将小鼠麻醉后,平躺放置在实验台面上,中指、食指固定小鼠尾部。
用刀片轻划小鼠尾侧静脉或尾正中动脉。待血液流出后,用移液枪吸取血液。取血完毕后,棉签按压止血。
腹主动脉采血
优点:采血法取血量大、不易溶血,血液质量较好,适用于多项目检测,且不损伤器官,有利于病理组织学检查。
缺点:操作比较复杂,应注意掌握适当的麻醉深度,防止心跳骤停,同时防止大鼠躁动。本方法造成的出血速度快,易造成出血性的心脏停跳,故要防止采血过程中出血。且本方法采血过程中如多次采血不宜拔出针头。
将大鼠腹腔注射麻醉剂后,直到身体全身变软,把大鼠仰卧固定在手术台上,背部可以放置—粗试管以充分暴露腹主动脉。
常规消毒后用手术剪刀沿腹正中线剪开腹腔,用小镊子轻轻扒开血管周围脂肪,再用棉球把覆盖在血管的多余脂肪擦干净,直到清晰看清血管为止(用棉球可以尽量减少小血管破裂出血,影响接下来进针时的视线)。
找腹主动脉(粉)在脊柱上面,腹腔静脉血管(比腹主动脉粗,黑)旁,找到后,术者先固定血管,尽可避免血管移位,左手拇指和食指固定住血管两旁的脂肪及其它脏器,无名指按住血管进针点的上端,降低血压,可以避免血液溅出。
右手持穿刺针,针尖斜面朝下,入针角度约(小于)30度左右,朝向心端方向刺入,深度以5m左右为宜,进针后可以用止血夹夹住针头,可以避免麻醉不够挣扎导致血管被针头戳破。
取完血后,用棉球轻压针眼处,快速拔出针头,可以反复采集多管的血样进行不同项目的测试(一般体重200~300g大鼠可采血液8~10mL)。
心脏采血(非必需勿用)
优点:取血快,血液不易凝集,心区面积大,进针准确性较高,可一针见血,且采血量能满足大量试验需要。
缺点:采血成功率较小,死亡率高,心脏损伤较大,难以迅速愈合,不利于短期连续采血,亦无法确定是静脉血还是动脉血。
一般有3种心脏采血的姿势:1、托起小鼠躯干使身体垂直与地面。身体直立以防止心脏的偏转或胸部的扭曲。使用1毫升注射器和22g针头。将针头从胸部中央向下5mm处插入,深度5-10mm,将注射器与胸部保持25-30度;2、使小鼠仰卧固定,剪去胸前区被毛,皮肤消毒后,用左手食指在左侧第3~4肋间触摸到心搏处,右手持带有4~5号针头的注射器,选择心搏最强处穿刺;3、使小鼠侧卧,垂直于胸壁插入针头。
如果血液没有立刻进入注射器,可以轻轻抽空针管,产生一个真空区。
当注射器中出现血液时,将针管保持静止并轻轻地抽拉活塞芯杆,以获得更多的血液。一般可以采到0.8-1.0ml血液。
摘除眼球采血
用左手拇指、食指和中指抓取小鼠的颈部头皮,小指和无名指固定尾巴,轻压需要摘取的眼部皮肤,使眼球充血突出。
用眼科剪剪去小鼠的胡须,防止血从胡须处顺流而下引起溶血。
用眼科弯镊夹取眼球并快速摘取,并使血液从眼眶内流入0.5mlEP管中。待小鼠取血完毕后,断颈处死。
断头采血
用左手拇指和食指以背部较紧的捏住小鼠颈部皮肤,并作小鼠头部朝下的姿势。
右手用剪刀猛剪鼠颈,约1/2-4/5的颈部剪断,让血滴入容器中。
全血、血浆、血清的区别

全血包括血细胞和血浆的所有成分。采集全血时,收集管中必须含有抗凝剂。常用的抗凝剂有:肝素、柠檬酸钠和乙二胺乙酸酸 (EDTA)。根据不同研究需要进行选择。
血浆是全血经抗凝处理后,通过离心沉淀,获得的不含细胞成分的液体。含有纤维蛋白原、凝血因子等。
血清是全血未经过抗凝处理,血凝块聚缩释出的液体。其中没有纤维蛋白原和凝血因子。
分离血浆和血清的一般方法是:2200-2500rpm 离心至少15分钟。
正常的血清或者血浆样本为黄色清液,而若为偏红,即为有红细胞破裂而产生溶血现象。避免溶血应注意以下的事项:
1.采血时要避免小鼠毛发、油脂沾染血液导致溶血,所用的容器、注射器必须清洁干燥,不能有水或者有机溶剂。
2.抽血时速度不要太快,速度太快会有气泡产生。如果使用止血带时,止血带不要扎的太久。
3. 抽出的血放入试管时,要先拔掉针头再放血,同时速度不要太快。
4. 收集分离血清的全血时应尽量使血液直接进入小管底部,避免管壁或管盖上的血液在离心过程中导致溶血
样本出现溶血还可以用ELISA方法检测吗?
血样采集操作失误、强力震荡和多次冻融都有可能引起溶血发生。
在ELISA检测中,若样本溶血轻微(浅红色),仍可做ELISA检测,建议适当增加洗板次数,减少背景过高影响;若溶血严重(深红色),建议重新取样。
样本溶血可能会引起ELISA检测OD值升高、结果假阳性。
原因可能是样本中游离的血红蛋白非特异性吸附在酶标板上,血红蛋白中的亚铁血红素具有类似过氧化物酶的活性,其作用类似于辣根过氧化物酶,进而催化底物的反应以增加样品的OD值并引起假阳性。

关注微信公众号

微信扫一扫立即咨询

微信扫一扫立即咨询